
In einem vorherigen Blog-Beitrag haben wir das Prinzip der Funktionsweise von Schnelltests auf der Grundlage des Lateral Flow Assay (LFA) vorgestellt. In diesem Beitrag werden wir uns ansehen, wie ein solcher Test für den Nachweis von COVID-19 aussehen könnte. Außerdem stellen wir drei Modelle vor, die zum Verständnis dieser einfachen, robusten und doch ziemlich fortschrittlichen Mikrolabors herangezogen werden können.
Wie funktionieren COVID-19-Tests?
Wenn der Körper mit dem Coronavirus SARS-CoV-2 infiziert ist, reagiert das Immunsystem schnell mit der Bildung von Antikörpern. Dendritische Zellen können Virusantigene präsentieren, um die Erkennung durch T-Zellen zu ermöglichen. T-Zellen können B-Zellen aktivieren, um Antikörper gegen das Antigen abzusondern (Ref. 1). Zu den ersten Antikörpern, die gebildet werden, gehören die so genannten IgM-Antikörper. Diese Antikörper heften sich an die Oberfläche von so genannten Antigenen auf den Viruspartikeln, sobald sie in deren Nähe kommen. Im Falle des Coronavirus kann es sich bei den Antigenen um die Spike-Proteine auf der Oberfläche des Virus (S-Antigen) handeln. Sobald die Antikörper an die Antigene gebunden sind, blockieren sie die Spike-Proteine des Virus und hindern sie daran, sich an menschliche Zellen zu heften und diese zu infizieren. Dadurch wird das Virus neutralisiert, da es sich außerhalb einer infizierten Zelle nicht mehr vermehren kann. Es gibt eine Reihe verschiedener Antikörper, die sich gegen unterschiedliche Antigene richten können. Es gibt jedoch auch andere Mechanismen zur Bekämpfung der Infektion. Darüber hinaus können T-Zellen, die das Virus erkennen, auch direkt gegen infizierte Zellen vorgehen. Sie können die Zellen anweisen, sich selbst zu zerstören, oder sie können die infizierten Zellen abtöten und damit ebenfalls das Virus neutralisieren.
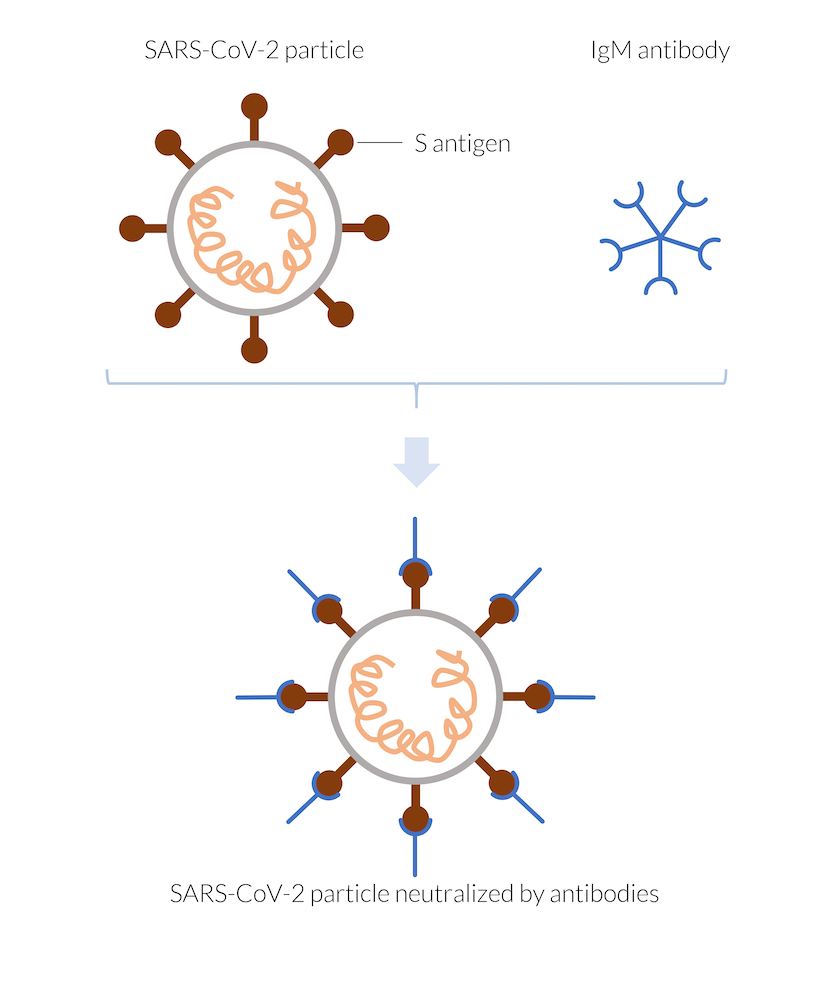
Die vom Immunsystem hergestellten IgM-Antikörper heften sich zum Beispiel an das Spike-Antigen (S-Antigen) des SARS-CoV-2-Viruspartikels und neutralisieren dadurch das Partikel. Das neutralisierte Virus kann nicht in eine menschliche Zelle eindringen und sich daher nicht vermehren. Das Viruspartikel wird zerstört.
Die IgM-Antikörper patrouillieren den Körper in Fünfergruppen, bilden kleine Partikel (oder große Moleküle) und heften sich an jedes Viruspartikel, dem sie begegnen. Im späteren Verlauf der Infektion bildet das Immunsystem auch andere Antikörper, z. B. IgG, die eigenständig durch den Körper wandern und sich an jedes Viruspartikel heften, das sie sehen. Die IgG-Antikörper brauchen länger, um vom Körper hergestellt zu werden, aber sie halten auch länger und gewährleisten Immunität, solange sie vorhanden sind.
Einige der LFA-Schnelltests zum Nachweis von COVID-19 basieren auf dem Nachweis sowohl von IgM- als auch von IgG-Antikörpern. Dies sind die Tests, die in dem in diesem Blog-Beitrag vorgestellten Modell untersucht werden.
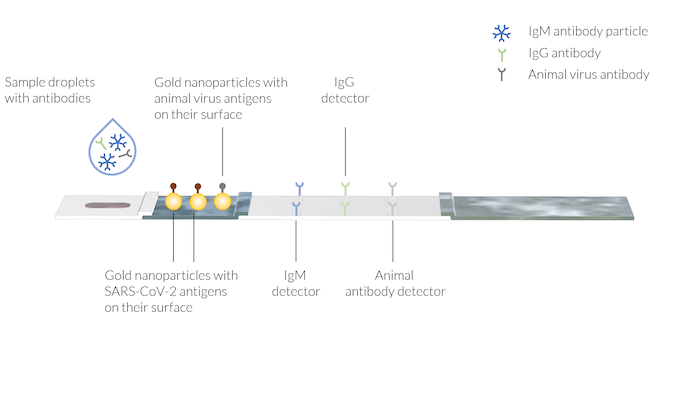
Die Probe enthält die menschlichen Antikörper IgM und IgG, die durch die COVID-19-Infektion entstanden sind. Außerdem wird der Probenflüssigkeit mit der Pufferlösung ein tierischer Antikörper zugesetzt. Die Testlinien sind an drei verschiedenen Stellen mit Detektoren für immobilisierte Antikörper versehen. Die Testlinien sind noch nicht sichtbar.
Das Blut (oder der Speichel) des Patienten kann auf die Probenvertiefung aufgetragen werden, anschließend wird der Puffer aufgebracht, indem ein paar Tropfen Puffer in die Probenvertiefung getropft werden.
Die Probe wird durch die Kapillarkräfte zum Konjugat-Pad transportiert. Hier lagern sich die IgM- und IgG-Antikörper an eine Konjugatmarkierung an. Eine Konjugatmarkierung kann beispielsweise ein Gold-Nanopartikel sein, das SARS-CoV-2-Antigene auf seiner Oberfläche trägt. Es werden zwei verschiedene Komplexe gebildet:
- IgM mit dem Konjugat (IgM-C)
- IgG mit dem Konjugat (IgG-C)
Diese Komplexe werden in der Probenflüssigkeit aufgelöst.
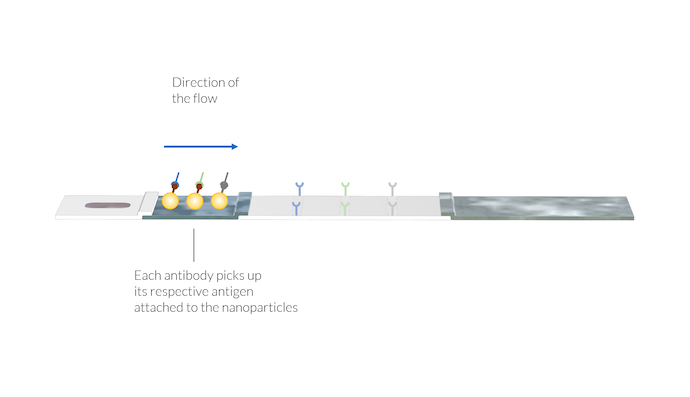
Die IgM- und IgG-Antikörper nehmen die Goldpartikel auf, indem sie sich an das SARS-CoV-2-Antigen auf der Partikeloberfläche binden. Auch der tierische Virus-Antikörper nimmt sein jeweiliges Partikel auf. Die Komplexe aus Antikörper und Partikel werden im Fluss aufgelöst und mit der Probenlösung zur Membran transportiert. Auch hier sind die Testlinien noch nicht sichtbar.
Darüber hinaus kann ein zweites Konjugat mit Antigenen aus tierischen Viren an Gold-Nanopartikel gebunden sein. Diese Konjugatmarker können an einen tierischen Referenzantikörper gebunden werden, der in der Pufferlösung enthalten ist. Der Komplex aus dem tierischen Antikörper und der Konjugatmarkierung (AA-C) ist ebenfalls in der Probenflüssigkeit gelöst und wird für den späteren Nachweis in der Kontrolllinie verwendet.
Die Probe wird dann durch die Kapillarkräfte zur Membran transportiert. In der ersten Testlinie werden bei der Herstellung der Membran IgM-Detektoren an der Oberfläche der Membran immobilisiert. Diese IgM-Detektoren fangen den IgM-C-Komplex ein und fixieren diese Komplexe im Bereich der Testlinie. Die Nanopartikel reichern sich an und zeigen das Vorhandensein des Komplexes auf der Testlinie an, indem sie die Testlinie rot färben.
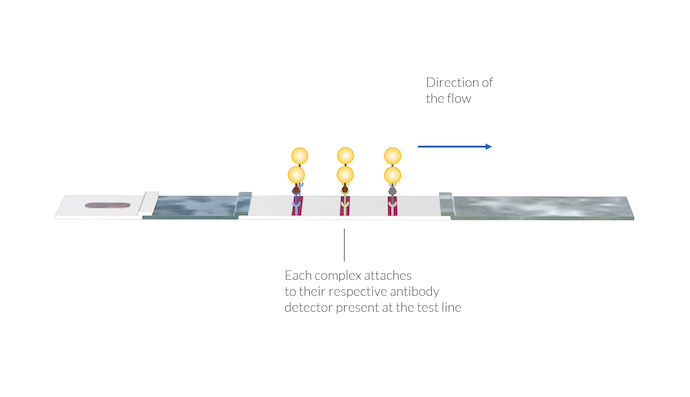
Die Antikörper-Antigen-Goldnanopartikel-Komplexe binden sich an ihren jeweiligen Antikörper-Detektor, der sich an der Position der Testlinien befindet. Sobald die Komplexe auf der Oberfläche der Testlinie immobilisiert sind, erscheint aufgrund der Anwesenheit der Gold-Nanopartikel auf der Oberfläche die Farbe der Testlinie.
Auf die gleiche Weise reagiert der IgG-C-Komplex mit immobilisierten IgG-Detektoren in der zweiten Testlinie. Sobald sich der IgG-C-Komplex an den IgG-Detektor bindet, verfärbt sich die zweite Testlinie aufgrund der Anwesenheit der Gold-Nanopartikel rot.
Die Kontrolllinie reagiert auf analoge Weise, wenn sie auf den AA-C-Komplex trifft, und zwar mit Hilfe von Antikörper-Detektoren, die an der Membran im Bereich der Kontrolllinie angebracht sind. Die Färbung der Kontrolllinie zeigt an, dass die Probe den Membranbereich, einschließlich der IgM- und IgG-Detektionsbereiche, passiert hat. Wenn die Kontrolllinie nicht gefärbt ist, sollte der Test verworfen werden, da die Probe die Membran nicht zufriedenstellend passiert hat.
Der Fluss führt weiter zum Absorptions-Pad (Wick Pad). Das Porenvolumen dieses Pads bestimmt die Probenmenge, die durch den Teststreifen fließen kann. Sobald der Absorptionsweg voll ist, stoppt der Durchfluss im Teststreifen. Die einzige Möglichkeit, den Fluss wieder in Gang zu bringen, besteht darin, einen Teil der Probenflüssigkeit im Absorptions-Pad zu verdampfen.
Drei Schnelltest-Modelle in COMSOL Multiphysics®
Wir nutzen drei Modelle, um einen LFA-Schnelltest zu untersuchen.
Zuerst verwenden wir ein vollständiges 3D-Modell, um herauszufinden, ob die Probenflüssigkeit gleichmäßig im Teststreifen verteilt ist, und um die Auswirkungen der Position der Probenvertiefung zu untersuchen. Auch die Absorptionskapazität des Absorptions Pads, das den Durchfluss durch den Teststreifen ermöglicht, kann mit dem 3D-Modell erforscht werden.
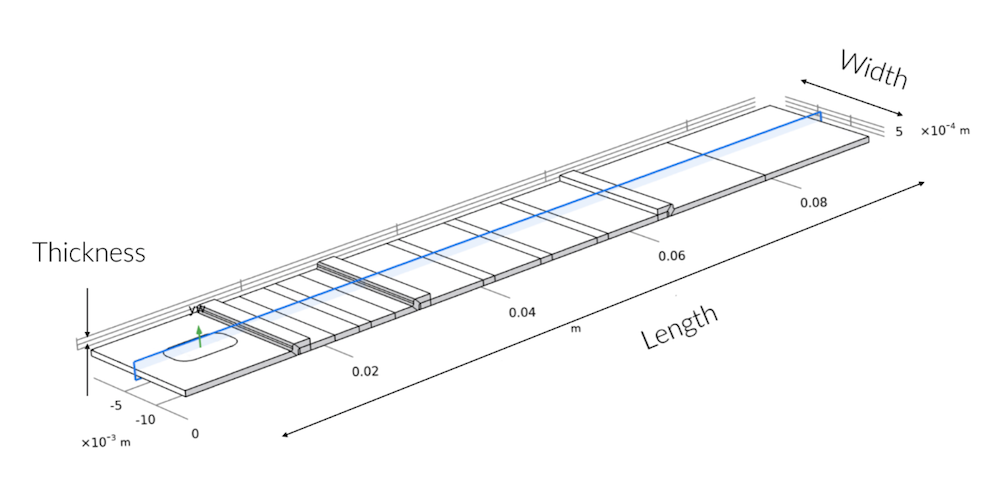
Der blau schattierte Querschnitt zeigt die 2D-Modellierungsebene in der 3D-Geometrie. Die Abweichung von der Symmetrie entlang der Breite findet sich nur im Sample-Pad, wo die Probenvertiefung nicht über die gesamte Breite des Teststreifens verläuft.
Es war schnell klar, dass die Probenflüssigkeit, sobald sie das Sample-Pad passiert hat, schnell ein flaches Geschwindigkeitsprofil bildet. Das bedeutet, dass sie gleichmäßig über die Breite des Teststreifens fließt. Dies lässt darauf schließen, dass ein 2D-Modell ausreicht, um die Herausforderungen und die Funktionsweise des Schnelltests zu verstehen, solange das Sample-Pad seine Aufgabe erfüllt und den Fluss gleichmäßig verteilt. Wir haben daher 2D-Modelle verwendet, um den Transport und die Reaktionen im Teststreifen zu untersuchen. Die 2D-Modelle ermöglichen es uns, eine höhere Auflösung des Netzes sowohl über die Länge als auch über die Stärke des Teststreifens zu verwenden.
Die Modelle kombinieren das Interface Richard’s Equation für Strömung in porösen Medien und das Interface Transport of Diluted Species in COMSOL Multiphysics® (Ref. 2). Die Reaktionen, die die IgM-C-, IgG-C- und AA-C-Komplexe bilden, werden über das Interface Chemistry definiert. Auch die Oberflächenreaktionen an den Testlinien werden durch das Interface Chemistry definiert. Für die 2D-Modelle haben wir zwei verschiedene Annahmen gemacht:
- Die Adsorption des Komplexes an den Testlinien findet nur an der Membranoberfläche statt
- Der Adsorptionsprozess findet entlang der kompletten Stärke der Membran unterhalb der Position der Testlinien statt
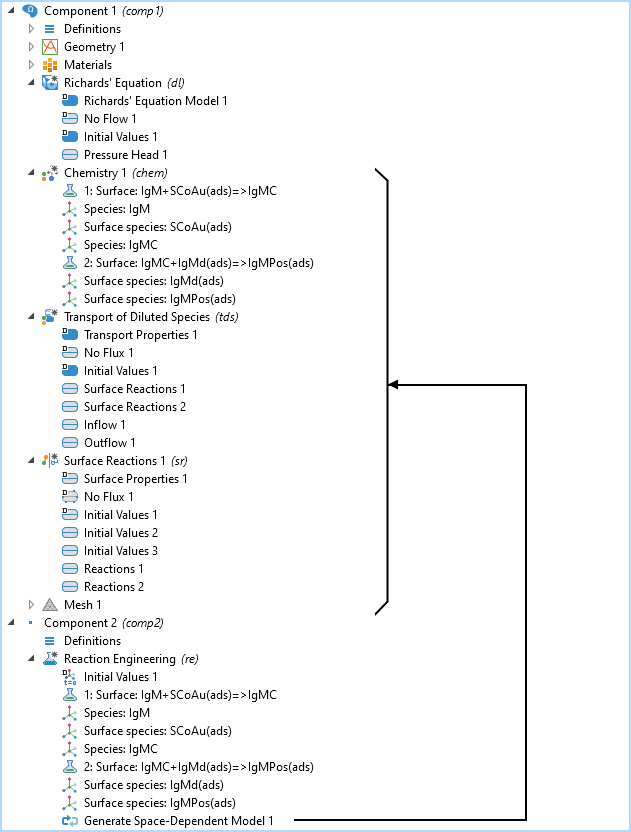
Der Modellbaum mit der 2D-Modell-Komponente mit dem Richard’s Equation Model, den Interfaces Chemistry, Transport of Diluted Species und Surface Reactions, sowie die 0D-Modell-Komponente mit dem Interface Reaction Engineering. Der Knoten Generate Space Dependent Model fügt die Transport- und Chemie-Interfaces zu der bereits existierenden 2D-Modell-Komponente mit dem Interface Richards’ Equation hinzu.
Die obenstehende Abbildung zeigt den Modellbaum für den IgM-Reaktionsweg. Die Interfaces Chemistry, Transport of Diluted Species und Surface Reactions werden alle von dem Interface Reaction Engineering erstellt, worin die chemischen Reaktionen mithilfe der Funktion Generate Space-Dependent Model definiert sind.
Die chemischen Reaktionen im Konjugat-Pad sind wie folgt definiert:
- Die Reaktion zwischen IgM und dem SARS Co-2-Antigen auf dem Gold-Nanopartikel im Konjugat-Pad ist definiert als: IgM +SCoAu(ads) => IgMC
- Der Begriff (ads) bedeutet, dass das Antigen und die Nanopartikel in der Porenstruktur des Konjugat-Pads adsorbiert und von IgM aufgenommen werden, um den Komplex IgMC zu bilden, der in der Lösung gelöst ist.
- Eine analoge Reaktion ergibt sich für den IgG-Antikörper: IgG + SCoAu(ads) => IgGC
- Die Reaktion des tierischen Antikörpers (AA) mit dem tierischen Antigen auf den Gold-Nanopartikeln (AAu) kann wie folgt definiert werden: AA + AAu(ads) => AAC
IgMC, IgC, and AAC sind dementsprechend Antikörper-Konjugat-Komplexe.
Folgende Reaktionen finden in den Testlinien statt:
- In der ersten Testlinie haben wir: IgMC + IgMd(ads) => IgMPos(ads)
- Der IgMC-Komplex reagiert mit dem adsorbierten IgMd-Detektorprotein und bildet die adsorbierte IgMPos-Oberflächenspezies. Durch die Bildung des immobilisierten IgMPos erhält die erste Testlinie ihre Nachweisfarbe.
- Analog zu oben, haben wir in der zweiten Testlinie: IgGC + IgGd(ads) => IgGPos(ads)
- Die adsorbierte Spezies IgPos verleiht der zweiten Testlinie ihre rote Farbe.
- In der dritten Testlinie haben wir schließlich: AAC + AAd(ads) => AAPos(ads)
- Die adsorbierte Spezies AAPos verleiht der Kontrolllinie ihre rote Farbe.
Die Modellergebnisse
Die folgende Abbildung zeigt das Strömungsprofil im Teststreifen zu vier verschiedenen Zeitpunkten. Es ist zu erkennen, dass die Probenfronten zunächst in der Mitte des Teststreifens weiter in den Teststreifen hineinreichen und ein leicht parabolisches Profil bilden. Das parabolische Profil ist auf die Position der Probenvertiefung in der Mitte des Teststreifens zurückzuführen. Nach fünf Sekunden jedoch, wenn der Fluss bereits etwa ein Drittel des Konjugat-Pads erreicht hat, ist das Flussprofil flach (siehe letzte Abbildung im vorherigen Blog-Beitrag).
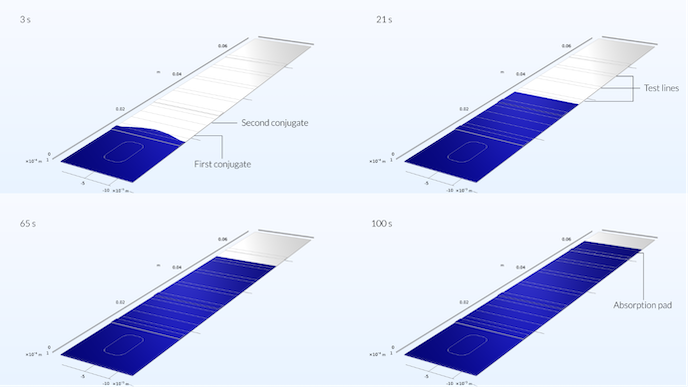
Die Probe erreicht bereits nach 3 Sekunden das erste Konjugat-Pad. Hier kann man noch den Einfluss der Position der Probenvertiefung auf die Ausbreitung der Probe erkennen, die sie nicht flach ist, sondern in der Mitte eine maximale Reichweite aufweist. Nach 21 Sekunden, wenn die Probe den ersten Testlinienbereich erreicht hat, ist das Geschwindigkeitsprofil eine gerade Linie. Nach 65 Sekunden hat der Fluss die Referenz-Testlinie erreicht, und nach 100 Sekunden hat er das Absorptions-Pad erreicht.
In diesem Diagramm können wir auch sehen, dass die Lösung symmetrisch entlang einer Ebene ist, die senkrecht zum Teststreifen in der Mitte des Kanals verläuft. Das bedeutet, dass wir das Problem auch nur für eine Hälfte des Tests hätten lösen können. Die Modellierung der gesamten Vorrichtung ist trotz der Tatsache, dass das Problem symmetrisch ist, eine gute Möglichkeit zu überprüfen, ob das Netz dicht genug ist, um Rückschlüsse auf das Strömungsprofil zu ziehen. Die Tatsache, dass das Strömungsprofil symmetrisch ist, zeigt uns, dass das Netz hier dicht genug sein müsste.
Betrachten wir das Diagramm der Fließgeschwindigkeit der Probe an der Position der ersten Testlinie; siehe Abbildung unten. Es ist zu erkennen, dass der Fluss etwa 20 Sekunden nach dem Aufbringen der Probe in die Probenvertiefung beginnt. Der Fluss stoppt bei etwa 275 Sekunden. Dies fällt mit dem Zeitpunkt zusammen, an dem das Absorptions-Pad mit der flüssigen Probe gefüllt ist.
Interessant ist auch, dass die Durchflussrate mit der Zeit fast exponentiell abnimmt. Dies ist darauf zurückzuführen, dass die Kapillarkräfte, die den Fluss antreiben, nur auf die Porenoberflächen wirken, an denen die Probenflüssigkeit auf Luft trifft (der Dreiphasengrenzbereich der Flüssigkeitsfront). Das bedeutet, dass diese Kraft konstant ist, solange noch freies Porenvolumen vorhanden ist, das sich mit Probenflüssigkeit füllen kann. Der Strömungswiderstand nimmt jedoch zu, wenn die Probenflüssigkeit weiter in den Teststreifen eindringt. Die mit der strömenden Probenflüssigkeit in Berührung kommende Porenwandfläche nimmt mit der Zeit zu, und damit auch die Fläche zwischen den Porenwänden und der strömenden Flüssigkeit, an der Reibung entsteht.
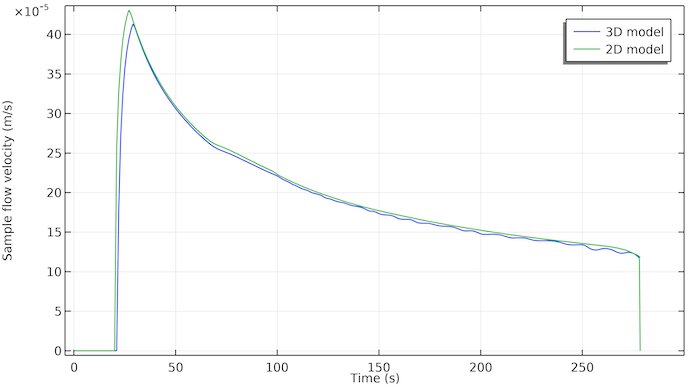
Die Fließgeschwindigkeit der Probe an der Position der ersten Testlinie für das 3D-Modell (blau) und das 2D-Modell (grün). Die beiden Kurven stimmen gut überein. Das 3D-Modell zeigt eine Verzögerung von etwa 2 Sekunden, die wahrscheinlich darauf zurückzuführen ist, dass die Probe zunächst über die Breite fließen muss. Im 2D-Modell ist die Probe sofort gleichmäßig über die Breite verteilt.
In der folgenden Abbildung ist die Konzentration des IgMC-Komplexes für verschiedene Zeitschritte dargestellt. Es ist zu erkennen, dass IgMC mit dem Flüssigkeitsstrom wandert, bis er den Bereich der ersten Testlinie erreicht. Hier wird er durch die Reaktion mit der IgM-Nachweisspezies verbraucht und bildet die farbige Nachweislinie. Das IgMC-Konzentrationsfeld zeigt, dass sich nach Erreichen der Testlinie eine Konzentrationsgrenzschicht bildet. Der Bereich nach der Testlinie, in dem die Konzentration sinkt, dehnt sich mit der Zeit weiter aus, aber der Bereich um die Testlinie erreicht einen fast stationären Zustand. Sobald der Durchfluss jedoch stoppt und das Absorptions-Pad durch die Probe gesättigt ist, bildet sich unterhalb der Testlinie ein breiterer Bereich mit abnehmender Konzentration, der sich über die gesamte Membran erstreckt. In ähnlicher Weise wird der Bereich unterhalb der Konjugationslinie durch die IgMC-Spezies gesättigt.
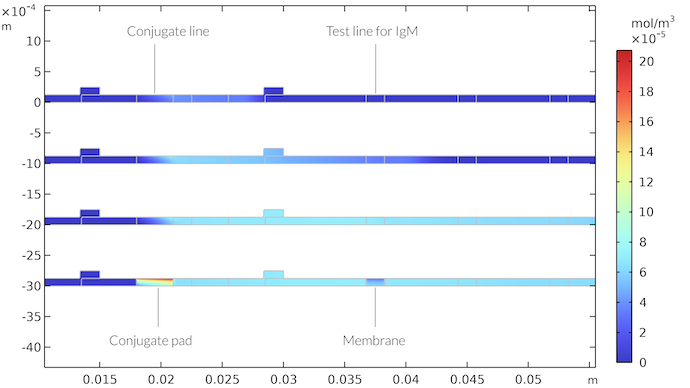
Das Konzentrationsfeld von IgMC als Funktion der Zeit am Konjugat Pad und in der Membran. Die dargestellten Zeiten sind nach 21 Sekunden (oben), nach 65 Sekunden, nach 260 Sekunden und nach 410 Sekunden (unten). Nach 410 Sekunden gibt es keinen Fluss mehr durch den Teststreifen. Wir erhalten eine Zone mit hoher IgMC-Konzentration im Konjugat Pad und eine Zone mit niedriger IgMC-Konzentration unterhalb der Testlinie für IgM.
Der Auswirkung des Flusses wird deutlich, wenn wir die Partikelkonzentration der Detektorspezies an der Oberfläche der Testlinie darstellen. Der Anstieg der Partikelkonzentration beginnt mit einer Verzögerung, die durch den Zeitpunkt gegeben ist, an dem der Fluss die jeweilige Testlinie erreicht. Die Konzentration steigt fast linear an, wenn IgMC im Bereich der Testlinie adsorbiert und die Detektorspezies IgMPos gebildet wird. Der lineare Anstieg bedeutet eine konstante Adsorptionsrate. Wenn der Durchfluss aufgrund der Sättigung des Absorptions-Pads stoppt, setzt sich die Bildungsrate von IgMPos in etwa gleichbleibend fort. Dies bedeutet, dass in diesem Fall die Bildung von IgMPos durch die Adsorptionskinetik bestimmt wird, d. h. durch die Adsorptionsrate der Gold-Nanopartikel in IgMC an der Adsorptionsstelle. Bei einem Massentransport würde sich die Steigung der Kurve ändern und das Wachstum würde sich verlangsamen, wenn der Fluss stoppt. Das könnte sich natürlich ändern wenn wir die Geschwindigkeitskonstante für die Adsorptionskinetik ändern. Die Testlinien werden bei etwa 1·108 Partikeln/mm2 sichtbar.
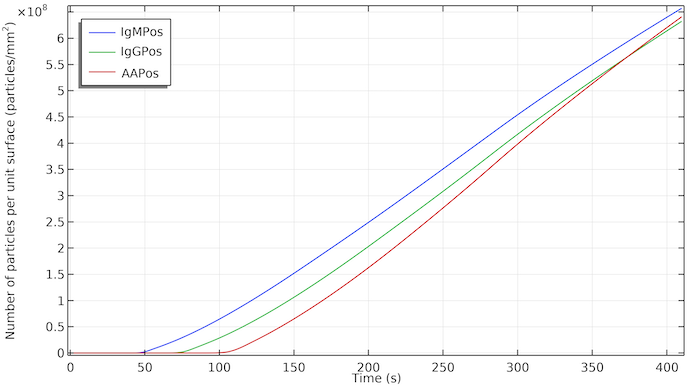
Die Konzentration von IgMPos, IgGPos und AAPos an der jeweiligen Testlinienoberfläche als Funktion der Zeit. IgMPos und IgGPos konkurrieren um dieselbe Konjugatmarkierung, weshalb die AAPos-Konzentration etwas schneller wächst.
Wenn also die Kinetik für die drei Testlinien ähnlich ist, würden wir eine Verzögerung des Erscheinens der ersten, zweiten und dritten (Kontroll-)Testlinie in dieser Reihenfolge sehen. Außerdem würde sich jede Testlinie an der dem Fluss zugewandten Kante zu färben beginnen, wobei die nachfolgenden Bereiche der Testlinien etwas später sichtbar werden.
Das homogene Modell zeigt ähnliche Ergebnisse, wenn wir die Kinetik an den homogenen Fall anpassen. Allerdings ist der Transport hier viel schneller, da die Reaktionsbereiche über die gesamte Stärke des Konjugat Pads und, bei der Testlinie, über die Membranstärke verteilt sind. Die Reaktanten müssen nicht an die Oberfläche des Teststreifens transportiert werden. Dies führt zu einem gemischteren Prozess, bei dem sowohl die Kinetik als auch der Massentransport das Erscheinen der Testlinie begrenzen. Die folgende Abbildung zeigt die IgMC-Konzentration, die dem obigen heterogenen Fall entspricht.
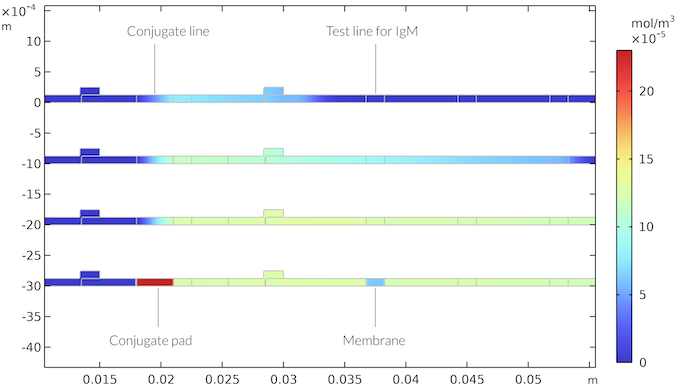
Die IgMC-Konzentration für den Fall, dass das Konjugat Pad die Konjugatmarkierung über die gesamte Stärke der Membran enthält und die Testlinie über die gesamte Stärke der Membran vorhanden ist. Die Ergebnisse sind ähnlich wie im heterogenen Fall.
Die folgende Grafik zeigt das Erscheinen der Testlinie. Es ist zu erkennen, dass sie mit einer kleinen Neigung in Flussrichtung fast gleichmäßig erscheint. Wenn der Fluss stoppt, erhalten wir eine höhere Farbsättigung an den beiden Rändern der Testlinie, da der Antikörper-Konjugat-Komplex durch Diffusion zu diesen Rändern transportiert wird.
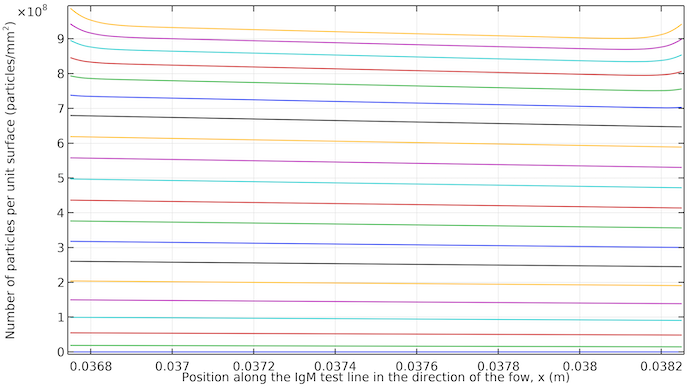
Konzentration von IgMPos pro Oberflächeneinheit integriert über eine Stärke von 10 μm an der IgM-Testlinie. Die Diagramme reichen von 20 Sekunden bis 400 Sekunden in 20-Sekunden-Schritten. Die Kurven beginnen bei 20 Sekunden im unteren Bereich (niedrige Sättigung) und enden bei 400 Sekunden im oberen Bereich (hohe Sättigung). Nach etwa 260 Sekunden liegen die Kurven zwischen den Zeitschritten näher beieinander, da der Antikörper-Konjugatmarkierung-Komplex dann nur noch durch Diffusion in den Bereich der Testlinie transportiert werden kann, wodurch sich der Prozess verlangsamt.
Die Realität liegt wahrscheinlich zwischen dem homogenen und dem heterogenen Modell. Ein guter Ansatz, um eine über die gesamte Breite gleichmäßig gefärbte Testlinie zu erhalten, wäre ein Detektionsvolumen nahe der Oberfläche des Teststreifens. Auf diese Weise wird der Transport entlang der x und y Richtung ermöglicht, und wir erhalten eine relativ große Reaktionszone (siehe Abbildung unten). Die Reaktionszone für die Testlinie auf die gesamte Stärke der Membran auszudehnen trägt nicht zu der Sichtbarkeit des Tests bei, da die Membran nicht transparent ist. Es hat jedoch Vorteile, wenn die Reaktionszone im Konjugat Pad über die gesamte Stärke verteilt ist, da dadurch die Reaktion zwischen der Konjugatmarkierung und dem Antikörper maximiert würde. Dadurch würde die Konjugatmarkierung so viele Antikörper binden wie möglich.
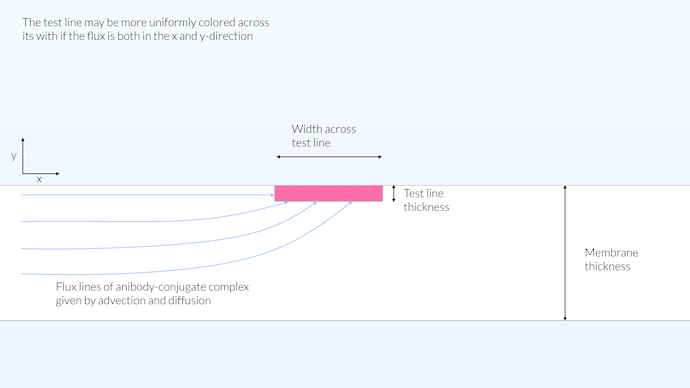
In dieser Konfiguration ist die Reaktionszone der Testlinie nicht auf die Oberfläche begrenzt und auch nicht auf die gesamte Stärke der Membran verteilt, sondern auf eine Stärke von 15 μm begrenzt. Die Membran ist nicht transparent sondern opak mit einer Sichttiefe von etwa 10 μm. Eine begrenzte Stärke der Testlinie ermöglicht den Transport über die gesamte Breite der Testlinie und ergibt eine relativ gleichmäßige Farbsättigung über die Breite der Membran.
Abschließende Gedanken
Das Intervall des Probenflusses durch den Teststreifen ist durch die Größe des Absorbtions-Pads gegeben, die auch die Größe der Probe bestimmt. Das ist natürlich offensichtlich und für Wissenschaftler und Ingenieurinnen, die mit LFA-Geräten arbeiten, nichts Neues. Interessanter ist, dass das Modell den exponentiellen Abfall der Flussrate vorhersagt, mit der die Probe über den Teststreifen transportiert wird, was Wissenschaftlern in diesem Bereich wohlbekannt, aber vielleicht nicht komplett offensichtlich ist.
Die 2D-Simulation zeigt, dass der Massentransport im Teststreifen, im heterogenen Fall, sehr langsam ist, aber die Adsorptionskinetik scheint ohnehin der die Flussgeschwindigkeit bestimmende Schritt zu sein. Der Fluss scheint die Probe schnell über den Teststreifen zu verteilen. Die Adsorptionsreaktion ist jedoch so langsam, dass sie die Bildung der Detektorspezies an den Testlinien im heterogenen Fall einschränkt. Im homogenen Fall ist die Kinetik umso mehr der begrenzende Faktor, da der Transport zum Reaktionsort genau in Flussrichtung liegt und nicht auf Diffusion angewiesen ist, zumindest solange ein Probenfluss stattfindet. Diese Ergebnisse hängen natürlich von den Eingangsdaten ab, die wir verwendet haben.
Die für diesen Blog-Beitrag erstellten Modelle sind was die Chemie betrifft sehr schematisch. Um sie für die reale Entwicklung von Teststreifen verwenden zu können, bedarf es eines größeren Aufwands bei der Generierung der Eingangsdaten für die Chemie und für die Eigenschaften der porösen Materialien. Allerdings enthalten die Modelle bereits die wichtigen Phänomene: relativ detaillierte Beschreibungen des Transports und der Reaktionen.
Mögliche Verbesserungen der Modelle
- Die Adsorption-Desorption überall entlang der Membran berücksichtigen: Hier nehmen wir an, dass alle Spezies frei transportiert werden, bevor sie an den Testlinien dauerhaft adsorbiert werden.
- Ein genaueres Modell der Zwei-Phasen-Strömung. Wir haben ein einfaches Zwei-Phasen-Strömungsmodell für poröse Materialien verwendet. Es könnte auch ein genaueres Modell genutzt werden, das auf dem Phasenfeld beruht.
- Eingabedaten von einem bestimmten in der wissenschaftlichen Literatur publizierten Test: Wir haben für alle Bereiche des Teststreifens die gleichen Eigenschaften für die Porosität und die Befeuchtung verwendet. Die Konzentrations- und Adsorptionskinetik verwendet Eingabedaten, die zu sinnvollen Ergebnissen führen. Es bedarf jedoch einer Literaturrecherche, um realistische Daten für die Konzentration und Kinetik zu verwenden. Diese würden sich jedoch für verschiedene COVID-19-Tests unterscheiden und jeder Hersteller hat seine eigene Vorgehensweise für Vorbereitung und Nachweis. Der Sinn dieses Blog-Beitrags ist es, mögliche Modellierungsansätze vorzustellen und nicht einen wissenschaftlichen Artikel zu veröffentlichen.
- Analyse der Netzkonvergenz. Dadurch könnte man die zu erwartende Genauigkeit der Simulationsergebnisse sehen. Das wurde zum Teil bereits gemacht, und wir wissen, dass die Modelle einen relativ kleinen numerischen Fehler haben. Eine strikterer Ansatz würde den Rahmen dieses Blog-Beitrags sprengen.
Referenzen
- L. Gutierrez, J. Beckford, and H. Alachkar, “Deciphering the TCR Repertoire to Solve the COVID-19 Mystery”, Trends in Pharmacological Sciences, vol. 41, no. 8, pp. 518–530, 2020, (https://www.cell.com/trends/pharmacological-sciences/fulltext/S0165-6147(20)30130-9),
- D. Rath and B. Toley, “Modelling-Guided Design of Paper Microfluidic Networks – A Case Study of Sequential Fluid Delivery”, ChemRxiv, 2020, https://doi.org/10.26434/chemrxiv.12696545.v1.
Modelle herunterladen
Bereit dazu, einen Schnelltest für COVID-19 zu modellieren? Klicken Sie hier, um die Modell-Dateien herunterzuladen:







Kommentare (0)